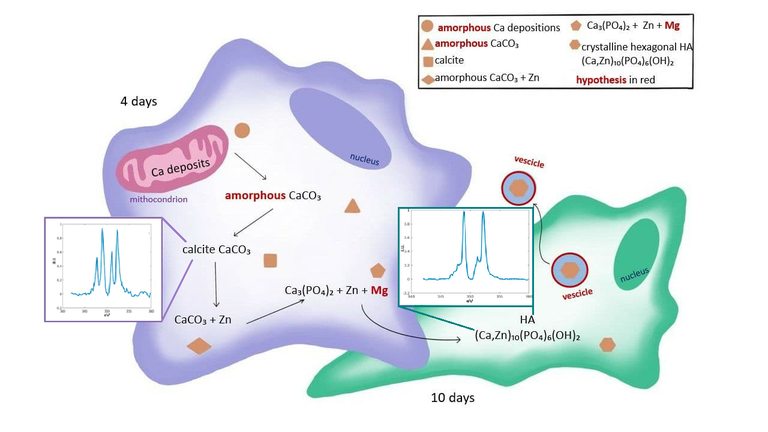
Figura. Modelo de las fases tempranas de biomineralización en el que se muestra la evolución de la localización y composición de los compuestos de calcio durante las fases tempranas de la diferenciación osteogénica. La figura muestra también los espectros de calcio e hidroxiapatito.
Cerdanyola del Vallès, 13 de julio de 2021. Un nuevo estudio desvela que el calcio de los huesos tiene su origen en una forma cristalina de carbonato de calcio, probablemente calcita. El equipo de investigación, formado por diversas instituciones italianas y el sincrotrón ALBA, estudió células madre humanas, durante el proceso de captación de calcio para transformarse en células de hueso. Gracias a la línea de luz MISTRAL de ALBA se pudo crear un tomograma 3D de las células y visualizar deposiciones de calcio en su interior. Este descubrimiento tiene aplicaciones potenciales en el desarrollo de nuevas terapias contra el cáncer de huesos.
Las células madre son células no especializadas que tienen el potencial de diferenciarse (transformarse) en un tipo concreto de célula con una función específica. Para convertirse en células de hueso, las células madre necesitan “aprender” como captar el calcio para formar los huesos. Esto está relacionado con la biomineralización, un proceso mediante el que los organismos vivos producen minerales, a menudo para endurecer los tejidos existentes. Se sabe que el calcio se encuentra en los huesos en forma de hidroxiapatito, un mineral natural formado por apatito de calcio que representa aproximadamente el 70% de la masa de los huesos.
En las células humanas la biomineralización culmina con la formación de hidroxiapatito, pero el mecanismo que explica la generación en el interior de la célula y la posterior propagación del mineral a la matriz extracelular sigue sin explicación. Además, su caracterización es muy controvertida, sobretodo en humanos.
Un equipo de investigación multidisciplinar, formado por diversas instituciones italianas y el Sincrotrón ALBA, llevaron a cabo técnicas de imagen basadas en sincrotrón para caracterizar los contenidos de las deposiciones de calcio en células madre humanas inducidas a diferenciarse en células óseas (osteoblastos). Compararon los resultados para células cuatro días y diez días después de la inducción osteoblástia.
Los resultados mostraron la presencia de una forma cristalina de carbonato de calcio, probablemente calcita, en las células madre tras 4 días, mientras que se encontraron cristales de hidroxiapatita y ninguna deposición de calcita en las células madre tras 10 días. Esto sugiere que la calcita es uno de los precursores en el proceso de biomineralización, lo que significa que la formación del hueso no comienza con fosfato de calcio amorfo, tal y como se pensaba anteriormente, sino como carbonato de calcio.
Este descubrimiento tiene potenciales aplicaciones en el desarrollo de nuevas terapias contra el cáncer de huesos (osteosarcoma), utilizando factores de diferenciación. Estas sustancias provocan que las células pasen de una forma inmadura a una madura. Las células tumorales malignas tienden a asumir un estado menos especializado o desdiferenciado, similar al de las células madre, de modo que las terapias basadas en agentes de diferenciación tienen el objetivo de ayudar a transformar las células cancerosas en células más normales y a que crezcan y se multipliquen más lentamente.
El equipo a cargo del estudio está formado por personas con formación en física, informática, química, bioquímica, biología y anatomía. Los centros colaboradores son la Universida de Bolonia, la Universidad de Milán, El Instituto Nacional de Bioestructuras y Biosistemas (Roma), el Chemical Center S.r.l (Bolonia) y la línea de luz MISTRAL del Sincrotrón ALBA (Barcelona).
Tomografía de rayos-X: Un mapa 3D de las células

Figura. (d) Renderización 3D codificada por color del núcleo y las estructuras densas de células madre mesenquimales, óseas 4 días tras la inducción osteoblástica. Los vóxeles (pixeles volumétricos) de las estructuras densas fueron seleccionados de forma automática utilizando un umbral. Tras el análisis espectral, solo algunas de estas estructuras densas mostraron contenido en calcio. Estos vóxeles ricos en calcio se muestran en (e). La barra de escala mide 2μm. / Las imágenes están basadas en microscopia de crio absorción de rayos-x cercana al vértice.
El equipo de investigación utilizó las técnicas de crio tomografía de rayos-X blandos (cryoSXT, por sus siglas en inglés) y crio microscopía de absorción de rayos-x cercana al vértice (cryoXANES, por sus siglas en inglés) en la línea de luz MISTRAL del Sincrotrón ALBA. MISTRAL permite visualizar en 3D las células en su estado natural. Gracias a esta tecnología punta, que solo está disponible en otros 3 sincrotrones en todo el mundo, investigadores biomédicos pueden llevar a cabo tomogramas de una célula con miles de veces más resolución que un escáner TC convencional.
Este estudio en concreto, tenía el objetivo de localizar y caracterizar la fase cristalina y la concentración de calcio en las deposiciones ricas en calcio en la fase temprana de biomineralización de las células madre estudiadas. La combinación de estas técnicas permite estudiar la biomineralización a nivel intracelular en células enteras hidratadas y congeladas en su estado nativo y con una resolución espacial de pocas décimas de nanómetros.
La técnica de CryoSXT consiste en registrar proyecciones 2D de transmisión de rayos-X blandos sobre un detector, cambiando la orientación de la muestra con respecto a la luz de sincrotrón incidente. Después, se generan mapas 3D de la muestra aplicando un algoritmo de reconstrucción.
Escaneando la energía a lo largo del vértice de interés, la cryoXANES aporta un espectro de absorción pixel a pixel y puede ser explotada para determinar el estado químico en 2D tanto de elementos ligeros como pesados en la muestra.
Referencia: Andrea Sorrentino, Emil Malucelli, Francesca Rossi, Concettina Cappadone, Giovanna Farruggia, Claudia Moscheni, Ana J. Perez-Berna, Jose Javier Conesa, Chiara Colletti,Norberto Roveri, Eva Pereiro and Stefano Iotti. Calcite as a Precursor of Hydroxyapatite in the Early Biomineralization of Differentiating Human Bone-Marrow Mesenchymal Stem Cells. Int. J. Mol. Sci. 2021, 22, 4939.DOI: https://doi.org/10.3390/ijms22094939
Con la colaboración de la Fundación Española para la Ciencia y la Tecnología. El Sincrotrón ALBA forma parte de la red de Unidades de Cultura Científica y de la Innovación (UCC+i) de la Fundación Española para la Ciencia y la Tecnología (FECYT) y ha recibido apoyo a través del proyecto FCT-20-15798.





