|
|
Cerdanyola del Vallès, 4 d'octubre de 2017. Plasmodium falciparum és el culpable de la malària. Aquest paràsit, transmès amb les picades de mosquit, arriba a la sang i infecta els glòbuls vermells de la seva víctima. Un cop dins, agafa com a nutrient l’hemoglobina (la proteïna encarregada del transport d’oxigen per la sang). Al digerir-la, es produeixen residus de ferro en forma de molècules anomenades hemo. Aquests grups hemo són tòxics per al paràsit però ell té una estratègia perquè no el perjudiquin: els ajunta de dos en dos i després els agrupa formant cristalls d’hemozoïna, de manera que el ferro tòxic queda bloquejat i ja no representa una amenaça per a ell. |
|
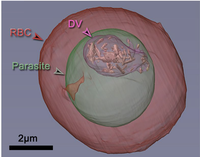
Tomografia on es veu el paràsit (marcat en verd) dins del glòbul vermell (RBC marcat en roig). En el paràsit s’observa el vacúol digestiu (DV) on es concentren els cristalls d’hemozoïna formats. |
|
Encara no se sap exactament com el paràsit cristal·litza els hemo, però ara el grup de recerca, liderat per Sergey Kapishnikov de la Universidad de Copenhagen, ha pogut calcular per primer cop la velocitat d’aquest procés de cristal·lització amb imatges del paràsit congelat in vivo. El fet clau del mecanisme bioquímic del paràsit és que s’han de coordinar les dues reaccions del procés: la digestió d’hemoglobina i la cristal·lització dels hemo. Com si d’una cadena de muntatge es tractés, la degradació inicial no pot ser més ràpida que la cristal·lització; si no, els tòxics grups hemo resultants s’acumularien i la maquinària següent encarregada de tractar-los no donaria a l’abast de convertir-los en cristalls. En conseqüència, els investigadors proposen un nou model del procés on prediuen que necessàriament hi ha d’haver un mecanisme que controli i reguli la velocitat de degradació d’hemoglobina i, per tant, també limiti l’alliberament de grups hemo.
Aquest descobriment és molt útil per al disseny de nous fàrmacs, l’objectiu dels quals seria sabotejar aquest procés de gestió de residus: ja sigui impedint la reacció que empaqueta els hemo tòxics; o bé fent que se n’acumulin molts atacant el sistema de coordinació entre ambdós passos – degradació i cristal·lització –, de manera que el paràsit acabi ofegant-se en les seves pròpies escombraries acumulades.
|
|
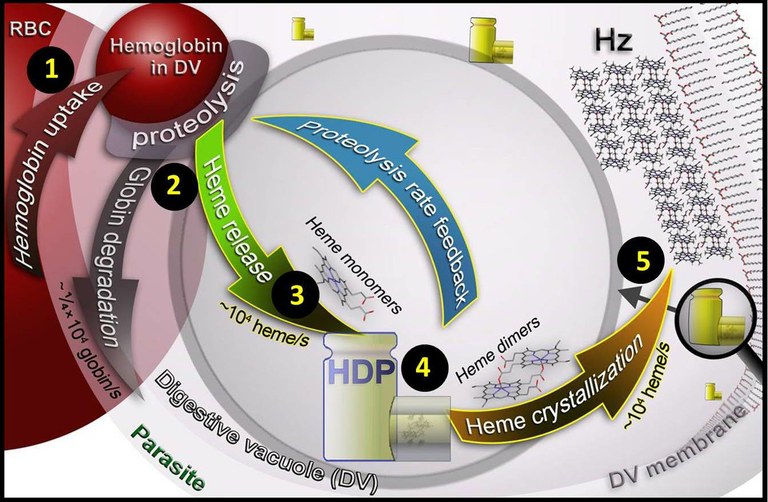
Model proposat del procés bioquímic que succeeix dins el paràsit. El paràsit agafa hemoglobina del glòbul vermell (RBC) 1 i la digereix dins el vacúol digestiu (DV) 2. Com a conseqüència s’alliberen grups hemo 3 que una proteïna (HDP) s’encarrega d’agrupar de dos en dos (heme dimers) 4 y i finalment té lloc la cristal·lització i es formen els cristalls d’hemozoïna 5. La fletxa blava indica el suggerit sistema de feedback per controlar la degradació d’hemoglobina.
|
La investigació s'ha realitzat gràcies a la cooperació entre diversos centres internacionals: el Niels Bohr Institute de la Universitat de Copenhagen, el Helmholtz Research Center de Berlín, el Paul Scherrer Institute de Suïssa, el Weizmann Institute of Science d'Israel, el Sincrotró ALBA, el sincrotró suís SLS i l'europeu ESRF a França.
Combinant dues avançades tècniques de llum de sincrotró
En el laboratori, els investigadors han infectat glòbuls vermells humans amb el paràsit i n’han obtingut imatges in situ desenvolupant una nova metodologia. La novetat és que han combinat dues avançades tècniques: la microscòpia de transmissió de raigs X tous i la microscòpia de fluorescència de raigs X. La primera, la microscòpia de raigs X de la línia de llum MISTRAL del Sincrotró ALBA, permet obtenir tomografies: imatges d’alta resolució en 3D de cèl·lules. Amb aquesta tècnica també es va estudiar el primer glòbul vermell infectat a BESSY-II, sincrotró de Berlín. Per la seva banda, la microscòpia de fluorescència de raigs X – duta a terme al sincrotró suís i més recentment al sincrotró ESRF a França – permet veure on es troben elements com el ferro, el potassi o el sofre dins la cèl·lula.
La proporció entre sofre i ferro per exemple, permet deduir si el ferro que s’observa amb la fluorescència és dels cristalls d’hemozoïna, de l’hemoglobina o són grups hemo lliures, i així acabar calculant les concentracions de les diferents molècules. A més, analitzant la quantitat de ferro present en el paràsit en funció del temps, s’ha deduït la ja comentada taxa de cristal·lització. Com que fins ara hi ha diversos models proposats de cristal·lització, cadascun amb la seva teòrica taxa, el càlcul fet in vivo ha permès identificar quin d’ells seria el més encertat.
|
|
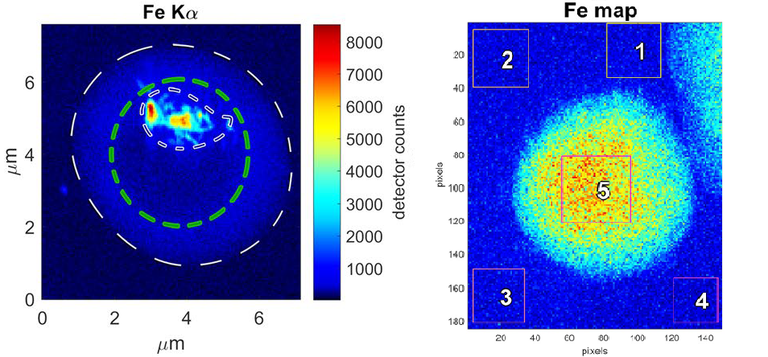
Mapes de fluorescència de ferro. A l’esquerra es veu una cèl·lula infectada on el ferro es concentra dins el vacúol digestiu del paràsit. Correspon al ferro present en els cristalls d’hemozoïna. |
Finalment, l’anàlisi de les imatges de microscòpia ha permès també mesurar per primer cop la presència de certa quantitat de grups hemo no cristal·litzats dins el paràsit. Això, és certament sorprenent perquè ja se sap que aquests compostos són tòxics de forma immediata i, segons la taxa de cristal·lització calculada, caldrien 1’4 hores per processar-los. Això significa que el paràsit té alguna manera de guardar aquests hemo perquè no el matin: “probablement associats a hemoglobina encara no digerida”, segons suggereixen els científics.
Una nova diana per atacar el paràsit
Tots aquests resultats han portat als investigadors a proposar un nou model de cristal·lització amb sistema de feedback, ja que tot plegat implica que les reaccions han d’estar controlades: la degradació de l’hemoglobina no pot ser més ràpida que la cristal·lització d’hemo. No saber exactament els mecanismes del paràsit ha estat alentint la recerca de tractaments contra la malària, malaltia que afecta centenars de milions de persones al món, molts dels quals infants. Actualment les resistències que apareixen al cap d’un ús continuat d’un cert fàrmac antimalàric clamen la necessitat de nous medicaments eficaços. El següent pas és doncs, veure com exactament es coordinen la degradació d’hemoglobina i la cristal·lització per tal de trobar un punt on atacar. Si aquest sistema d’informació s’interrompés, el paràsit moriria.